Фізичні та хімічні властивості води

Вода - це справжнє джерело життя на землі, вона приймає участь у безлічі біологічних процесів і є невід'ємним їх компонентов. Це можливо завдяки тому, що наявні фізико-хімічні властивості води.
У блозі ми часто посилаємося на певні властивості води, але рідко розкриваємо їх суть. Сьогодні спробуємо побути Вікіпедією і зануритися в курс фізики та хімії води, простою мовою розповісти про те, чому ж вона не тільки "джерело життя на землі", а й воістину особлива хімічна речовина. А також розглянути хімічні та фізичні властивості води.
Фізичні властивості води
Чиста вода не має смаку і запаху, за нормальної температури (20 оС) знаходиться в рідкому вигляді.
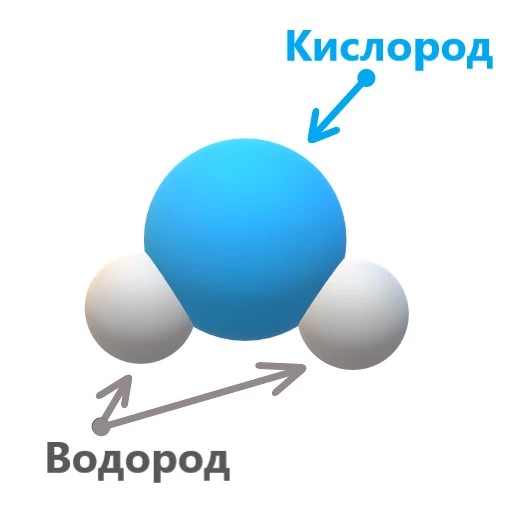
Щоб визначити формули води, то дізнаємось хімічний склад питної води та характеристики води. "Вода" - це тривіальна назва, вода в хімії називається оксидом водню.Хімічна назва води дає зрозуміти, що в склад молекули води містить іони водню і кисню, які пов'язані між собою так званим ковалентним зв'язком.
Атом водню має валентність (здатність утворювати зв'язки) 1, а атом кисню - 2. Завдяки цьому формула питної води саме H2O.
Також кожна молекула води здатна утворювати до чотирьох водневих зв'язків (2 з них водень, 2 кисень). Всі аномалії фізичних властивостей води пов'язані саме з ними — у води досить висока температура кипіння (100°C). Якби не існувало водневих зв'язків, то вода кипіла б при температурі -80°C, а замерзала б при -100°C. Така будова води дозволяє нам бачити її в трьох агрегатних станах (лід, рідина, газ) в навколишньому природному середовищі. Детальніше про те, як кипить і замерзає вода, як та чим відрізняється важка вода, а також про парадокс Мпемби, ми писали раніше.
Хімічні властивості води
Тут ми детальніше поговоримо про те, які хімічні властивості може проявляти вода, і як вони пов'язані з показниками води на Землі.
Якщо розглядати воду, як компонент реакцій, то основні властивості води, які потрібно знати, щоб розуміти процеси в навколишньому середовищі, треба розуміти з чим реагує вода.
Формула води
Формула води являє собою з'єднання з двох атомів водню (H) і одного атома кисню (O). Ця проста, але потужна структура зумовлює безліч властивостей, які зробили воду унікальним речовим середовищем.
Полярність молекул води зумовлена різницею в електронегативності між атомами водню і кисню. Це призводить до створення диполя, що робить воду чудовим розчинником. Завдяки цій здатності розчиняти безліч речовин, вода відіграє ключову роль у багатьох біологічних і хімічних процесах.
Взаємодія води з простими речовинами
З лужними та лужноземельними металами взаємодія відбувається досить бурхливо з виділенням тепла, а іноді навіть світла, наприклад, натрій, калій, кальцій здатні рухатися і навіть "стрибати" по воді.
2Na + 2H2O = H2 + 2NaOH.

Менш активні метали реагують або при нагріванні, або не реагують зовсім, наприклад залізо:
3Fe + 4H2O = 4H2+ Fe3O4 (лише при нагріванні)
Ці реакції в природному середовищі не відбуваються, а ось реакція корозії, коли до води приєднується повітря, дуже навіть поширена:
4Fe + 3O2 + 6H2O ➝ 4Fe(OH)3.
Це рівняння описує формування іржі на залізних поверхнях. Подібні процеси можуть відбуватися також з міддю, цинком і їх сплавами.
Реакції з неметалами відбуваються виключно при нагріванні або інших типах впливу. Вони також не принципові для вивчення властивостей води.

Реакції з оксидами неметалів
Дуже часто вода в природі зустрічається з вуглекислим газом, а також оксидами сірки та азоту, які є компонентами вихлопних газів, за таким механізмом:
SO2 + H2O = H2SO4.
В результаті саме цих процесів утворюються кислотні дощі.

Фотосинтез
Ця унікальна реакція дозволяє рослинам під впливом сонячного випромінювання з вуглекислого газу і води синтезувати поживні речовини: крохмаль і глюкозу.
6nCO2 + 5nH2O = (C6H10O5)n + 6nO2
Це, мабуть, все реакції, які можуть бути цікаві щодо води, як окремого елемента.
Вода – ідеальний розчинник
Вода є ідеальним розчинником, тому багато процесів відбувається невидимо для нашого ока. Ось вони — якраз, і найцікавіші. У природі не існує води, яка не містить домішок. У воді завжди розчинені неорганічні солі, гази, а при антропогенному впливі ще й величезний асортимент органічних речовин.

Наприклад, природна твердість води обумовлена тим, що під час її руху через породи, вона насичується мінералами. Залежно від складу порід, їх розчинності, температури навколишнього середовища певні їх концентрації здатні розчинятися у воді. Переважно такі породи представлені карбонатами, сульфатами, нітратами кальцію, магнію, натрію, калію та ін. катіонів. Мабуть, основними мінералами, які становлять базис жорсткості, є гіпс (CaSO4), доломіт (CaCO3 • MgCO3), вапняки (CaCO3).
Що стосується розчиненого заліза і марганцю, то вони характерні переважно для природних свердловинних вод, оскільки розчинні солі заліза зазвичай "мешкають" в просторі з недостачею повітря. Джерелами їх є переважно магнітний, бурий, червоний залізняки, магнезит та ін.
Сірководень також зберігається глибше ґрунтових вод, як продукт хімічних процесів серед органічних речовин. На повітрі теж схильний окиснюватися до елементарної сірки й випадати в осад (зазвичай невидимий людському оку).
У природних поверхневих водах завжди міститься розчинений кисень і азотовмісні компоненти, які виходять як наслідок життєдіяльності мікроорганізмів — це амоній, нітрити, нітрати, які з легкістю перетворюються один в одного. Також у водоймах завжди є білки й амінокислоти.

Що ж стосується антропогенного навантаження, то саме завдяки йому в воду вносяться найтоксичніші забруднювачі:
- солі важких металів;
- промислові органічні продукти;
- нітрати й фосфати застосовуються як добрива.
У воді постійно відбуваються якісь реакції. Це й обмінні процеси, які викликають, наприклад, осадження накипу, що складається з карбонату кальцію. І окислювально-відновні, через які у свердловинній воді з'являється рудувата залізна муть або осад на стінках. Вода — це складна хімічна система, і кожен елемент завжди має своє джерело.
Властивості води для організму людини
Вода грає ключову роль у підтримці життя і здоров'я організму людини. Її властивості впливають на різні аспекти функціонування організму:
-
Вода є основним компонентом клітин, тканин і органів. Постійне вживання води підтримує оптимальний рівень гідратації, забезпечуючи нормальне функціонування клітин.
-
Вода бере участь у процесах терморегуляції. Шляхом випаровування через піт і дихання вона допомагає охолоджувати організм в умовах підвищеної температури.
-
Вода служить середовищем для транспортування поживних речовин, мінералів і кисню до клітин органів і тканин.
-
Багато хімічних реакцій, що відбуваються в організмі, залежать від участі води. Вона служить середовищем для різних біохімічних процесів, включаючи розщеплення їжі в шлунку.
-
Вода відіграє важливу роль у виведенні токсинів і відходів через сечовидільну систему і піт.
-
Вода бере участь у підтримці оптимального рівня pH в організмі, що важливо для багатьох біологічних процесів.
-
Вживання достатньої кількості води допомагає поліпшити травлення, розбавляючи шлункові соки і полегшуючи переміщення їжі по кишечнику.
З урахуванням цих властивостей важливо підтримувати достатній рівень споживання води для забезпечення нормального функціонування організму і підтримки загального здоров'я.
Ресурси:
-
Гринь, В. "ФІЗИЧНІ ВЛАСТИВОСТІ ВОДИ." студентського наукового товариства (2010): 14.
-
Якименко, Анна. "Вивчення властивостей води." URL: http://fyzikaschool.ucoz.ua/doslidnu/Yakimenko-2-.pdf (дата звернення: 12.07.2023).
-
запасів води на Землі, Розподіл. "Склад та властивості води. Фізичні та хімічні властивості питної води." ПРИРОДНЕ НАВКОЛИШНЄ СЕРЕДОВИЩЕ ТА ЗДОРОВ’Я ЛЮДИНИ: 41.
-
Пашківська, О. С., and Н. В. Бродецька. "Вода та її значення для здоров'я людини." Біологічні дослідження-2013 (2013): 186-187.
Часті питання
Які властивості має вода у різних станах?
Вода в рідкому стані прозора, що дає змогу світлу проникати крізь неї. Вода досягає найвищої густини за температури близько 4 градусів Цельсія, що важливо для живих організмів і впливає на тепловий обмін у водних екосистемах. Вода хороший розчинник, здатний розчиняти безліч речовин, що відіграє важливу роль у хімічних процесах.
Вода у твердому стані утворює кристалічну решітку, що робить лід прозорим і таким, що відбиває світло. На відміну від більшості речовин, вода розширюється при замерзанні, що має важливі наслідки для природи.
Вода в газоподібному стані може розширюватися, заповнюючи об'єм.
Ці властивості води в різних станах є основою для багатьох природних процесів і мають важливе значення для підтримання життя на Землі.
Як називається 4-й стан води?
Четвертим станом води є водяна пара. Вода в четвертому стані проходить через фазовий перехід під впливом енергії магнітного поля в точці Кюрі. У цей момент вона набуває властивостей сегнетоелектричної плазми. Це основа для формування природних явищ, таких як грозові хмари і кульова блискавка.
Яка властивість води є найбільш істотною?
Вода має унікальну здатність розчиняти безліч речовин, що робить її життєво важливим компонентом для підтримання хімічних процесів в організмах, а також для формування і підтримки екосистем на Землі.
 (050) 384-17-65
(050) 384-17-65